Отдел осуществляет научно-производственную, контрольную и научно исследовательскую работу и принимает прямое участие в выполнение государственной работы «Экспертиза лекарственных препаратов для ветеринарного применения с целью их государственной регистрации».
- Основными направления осуществляемой Отделом работы являются:
- 1. Научная экспертиза качества лекарственного средства и экспертиза отношения ожидаемой пользы к возможному риску применения лекарственных препаратов, поступивших в ФГБУ «ВГНКИ» осуществляется путем изучения и оценки:
- 2. Путем оценки соответствия положений инструкции материалам регистрационного досье для обоснования показаний, режима дозирования заявляемого к регистрации лекарственного препарата, и сроков возможного использования продукции животного происхождения после его применения, и сопоставления регламентированных показателей с инструкциями по применению лекарственных препаратов-аналогов, находящихся в обращении, проводится экспертиза проектов инструкций, представленных на согласование
- 3. В целях международной гармонизации и совершенствования требований к процедуре экспертизы, регистрации лекарственных препаратов, контроля качества, оценки эффективности и безопасности осущесвляются следующие виды работ:
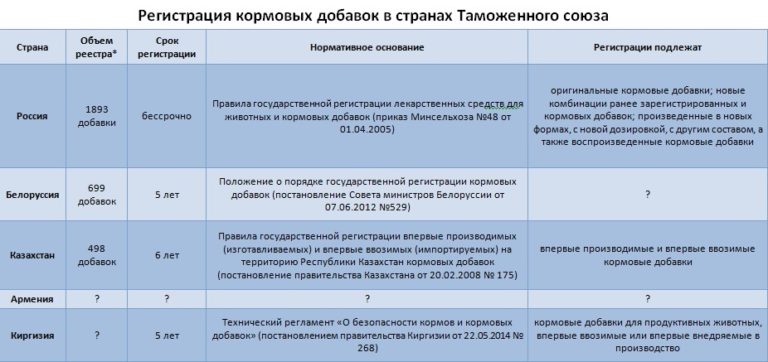
- Регистрация кормовых добавок
- Сроки и стоимость услуг:
- Процесс регистрации:
- 🌟 Видео
Основными направления осуществляемой Отделом работы являются:
- Оценка качества, эффективности, безопасности для животных, человека и окружающей среды фармакологических, биологических лекарственных средств для ветеринарного применения и кормовых добавок, заявляемых для государственной регистрации.
- Экспертиза представляемых Россельхознадзором на согласование проектов инструкций по применению лекарственных препаратов для ветеринарного применения и кормовых добавок и других документов, регламентирующих их рациональное использование в ветеринарии и животноводстве.
- Анализ системы научной экспертизы и научно-методического обеспечения в сфере обращения лекарственных средств в ведущих экспертных организациях Минздрава России и зарубежных стран, в целях международной гармонизации требований к качеству, эффективности и безопасности лекарственных средств.
1. Научная экспертиза качества лекарственного средства и экспертиза отношения ожидаемой пользы к возможному риску применения лекарственных препаратов, поступивших в ФГБУ «ВГНКИ» осуществляется путем изучения и оценки:
- полноты и достоверности сведений, содержащихся в материалах, обоснованности отражения показателей качества, эффективности, безопасности лекарственного препарата, выполнения требований к доклиническим и клиническим исследованиям;
- нормативного документа (ТУ или СТО отечественных организаций-производителей, спецификаций и методов контроля зарубежных организаций-производителей) на соответствие показателей качества лекарственного средства, регламентированных производителем, и методов их контроля требованиям государственной фармакопеи и требованиям межгосударственных и национальных стандартов(в части стандартизации);
- отношения ожидаемой пользы к возможному риску применения лекарственного препарата.
По результатам проведенных экспертиз оформляются сводные заключения, которые представляются для обсуждения в профильные методические комиссии ФГБУ «ВГНКИ». В случае невозможности проведения экспертиз (если объекты исследований и материалы непригодны и/или недостаточны для их выполнения) оформляются запросы о представлении дополнительных материалов лекарственные препараты и фармацевтических субстанций.
Подготавливаются и докладываются на заседаниях Комиссии экспертов по фармакологическим лекарственным средствам ФГБУ «ВГНКИ» заключения по материалам, представленным в целях регистрации, подтверждения регистрации лекарственных препаратов, внесения изменений, требующих экспертной оценки, в регистрационные документы зарегистрированных лекарственных препаратов, внесения в Государственный реестр фармацевтических субстанций.
2. Путем оценки соответствия положений инструкции материалам регистрационного досье для обоснования показаний, режима дозирования заявляемого к регистрации лекарственного препарата, и сроков возможного использования продукции животного происхождения после его применения, и сопоставления регламентированных показателей с инструкциями по применению лекарственных препаратов-аналогов, находящихся в обращении, проводится экспертиза проектов инструкций, представленных на согласование
Видео:ПОСЛЕДНИЕ ИЗМЕНЕНИЯ В ПРАВИЛАХ РЕГИСТРАЦИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ЕАЭС | Учебный Центр GxPСкачать

На запросы Центрального и региональных управлений Россельхознадзора и организаций-разработчиков средств, применяемых в ветеринарии и животноводстве подготавливаются экспертные заключения о принадлежности выпускаемой отечественными и зарубежными производителями продукции к лекарственным средствам для ветеринарного применения, объемах доклинических и клинических исследований, необходимых для оценки эффективности и безопасности лекарственных препаратов, представляемых к регистрации.
3. В целях международной гармонизации и совершенствования требований к процедуре экспертизы, регистрации лекарственных препаратов, контроля качества, оценки эффективности и безопасности осущесвляются следующие виды работ:
- изучение правовой и научно-технической информации по вопросам обращения лекарственных средств, опыта работы ведущих экспертных организациях Минздрава России, в том числе ФГБУ «Научный центр экспертизы средств медицинского применения», стран ЕС и Евразийского экономического союза;
- участие в семинарах, проводимых в ведущих экспертных организациях Минздрава России и компаний зарубежных стран;
- участие в деятельности рабочих групп Евразийского экономического союза (ЕАЭС), ответственных за разработку и гармонизацию требований к материалам регистрационного досье на лекарственные препараты, которые будут регистрироваться на таможенной территории ЕАЭС и рабочей группы по разработке единой Фармакопеи ЕАЭК.
- разработка нормативных и методических документов, регламентирующих обращение лекарственных средств для ветеринарного применения в Российской Федерации и на территории Евразийского экономического союза (ЕАЭС).
- организация и проведение научно-практических семинаров для представителей фармацевтического бизнеса с целью повышения квалификации специалистов организаций-разработчиков и организаций-производителей лекарственных средств для ветеринарного применения.
Регистрация кормовых добавок
Кормовые добавки – незаменимые элементы в современном животноводстве, которые в комплексном взаимодействии с зоотехнологиями способны значительно увеличить прибыль и качество производимых продуктов (мяса, молока, яиц).
Согласно Федеральному закону от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» обязательным условием для ввода в обращение лекарственных препаратов и кормовых добавок для ветеринарного применения является государственная регистрация как отечественных, так и импортных кормовых добавок.
В соответствии с приказом Минсельхоза РФ от 01 апреля 2005 г. № 48 «Об утверждении Правил государственной регистрации лекарственных средств для животных и кормовых добавок» обязательной регистрации подлежат:
Видео:Центр сертификации и регистрации ветеринарных лекарственных средств, кормов и кормовых добавокСкачать

- оригинальные добавки;
- новые комбинации зарегистрированных ранее добавок;
- добавки, зарегистрированные ранее, но произведенные в других формах, или с новой дозировкой, или с другим составом вспомогательных веществ;
- воспроизведенные добавки;
- премиксы.
Агро Азбука оказывает следующие услуги:
- Предоставляем информацию по документам, необходимым для проведения исследований и экспертизы кормовой добавки.
- Проводим оценку представленной Заказчиком документации, с целью определения полноты комплектности и соответствия документов требованиям РФ.
- Проводим разработку необходимых нормативных, технических документов на препарат, в том числе ТУ и инструкцию, с целью формирование регистрационного досье.
- Организуем проведение токсикологических испытаний и испытаний на определение эффективности применения.
- Оформляем отчеты об испытаниях.
- Готовим документы для подачи регистрационного досье в Госорганы, в том числе составить регистрационное досье для подачи.
- Обеспечиваем полное сопровождение процедуры регистрации на всех его этапах.
Сроки и стоимость услуг:
Срок регистрации — от 6 месяцев.
Стоимость услуг ООО ТД «Агро Азбука» обсуждается индивидуально с каждым клиентом по каждой отдельной добавки или премиксу. (возможны доп. условия и скидки при регистрации нескольких препаратов)
Дополнительные затраты и фиксированная стоимость услуг гос. организаций
- Испытания на эффективность применения. Стоимость испытаний на эффективность применения зависит от целевых животных, для которых предназначена кормовая добавка.
Процесс регистрации:
Видео:Что должен знать и уметь менеджер по регистрации лекарственных средств? | Учебный Центр GxPСкачать

Агро Азбука оказывает индивидуальный подход к каждому клиенту в организации полного комплекса услуг в соответствии со всеми стандартами качества по государственной регистрации кормовых добавок:
• формирование регистрационного досье
• направление образцов на проведение испытаний по определению острой, подострой, субхронической и хронической токсичности; эффективности применения добавки
• разработка и/или внесение изменений в нормативную документацию
• запросы в Госорганы РФ, ответы на вопросы экспертов
• сопровождение документации на всех этапах государственной регистрации
Видео:Фармакокинетика: всасывание, распределение, биодоступность лекарственных препаратовСкачать

• внесение изменений в Свидетельства о государственной регистрации кормовых добавок и др.
• квалифицированная консультативная помощь по вопросам регистрации кормовых добавок в Госорганах РФ.
• квалифицированная консультативная помощь по вопросам регистрации ветеринарных препаратов, кормовых добавок и другой продукции ветеринарного назначения (имплантов для животных и т.п.)
• отдельные виды услуг, которые могут включать в себя предварительную экспертизу регистрационного досье, предоставляемого в Госорган РФ, составление сопроводительных документов, разработку проектов инструкций, этикеток и нормативного документа (ТУ, СТО), регламентов производства в соответствии с требованиями GMP, подготовку недостающих документов
• организация необходимых исследований кормовых добавок в лабораторных и производственных условиях (в научных учреждениях Российской Федерации, сертифицированных исследовательских лабораториях, животноводческих хозяйствах и в ветеринарных клиниках), составление научных отчетов, актов
• представление интересов Заявителя в государственных органах по регистрации и сертификации
Видео:Регистрация лекарств | Введение в специальностьСкачать
• сопровождение регистрационного процесса, включающее — консультации по вопросам регистрации, — предварительную экспертизу регистрационного досье, — составление сопроводительных документов, — разработку проектов инструкций и этикеток, — формирование регистрационного досье,
— представление интересов производителя.
Государственную регистрацию осуществляет Минсельхоз России на основании экспертного заключения федерального государственного бюджетного учреждения .
Документом, подтверждающим государственную регистрацию, является Свидетельство о государственной регистрации кормовой добавки, которое выдается бессрочно.
https://www.youtube.com/watch?v=UCFz3xXx6-0
Члены Таможенного Союза в соответствии с Едиными ветеринарными (ветеринарно-санитарными) требованиями, предъявляемыми к товарам, подлежащим ветеринарному контролю и Положением о Едином порядке осуществления ветеринарного контроля на таможенной границе Таможенного союза и на таможенной территории Таможенного союза взаимно признают результаты регистрации кормовых добавок уполномоченными органами стран-членов Таможенного союза.
Специалисты Агро Азбука готовы ответить на все ваши вопросы — оставьте вашу заявку на сайте, чтобы мы могли предварительно подготовить для вас ответ или информацию:
🌟 Видео
Незаконный оборот лекарственных средств для животных.Скачать

Урок 2: Корма. Кормовые добавки. Лекарственные препараты и дезинфицирующие средстваСкачать

28.2. Средства для лечения гипохромной и гиперхромной анемииСкачать

Автоматическая линия сериализации и агрегации лекарственных средств и Биологически активных добавокСкачать

Круглый стол «Вопросы регулирования лекарственных препаратов для лечения животных»Скачать

Регистрация лекарственных средств | X7 Research | Клинические исследованияСкачать

Петрова Ю.Н. Государственный реестр ветеринарных препаратов РКСкачать

1.5. Фармакокинетика: БиотрансформацияСкачать

Мастер-класс «Правовые основы обращения лекарственных средств в РФ»Скачать

2.1 Фармакодинамика: Виды действия лекарственных средствСкачать

VetSkills «Технология изготовления лекарственных форм»Скачать

Система маркировки лекарственных препаратов на производствеСкачать

1 2 Классификация кормовСкачать

Отпуск лекарственных препаратов по требованиям мкдорганизаций с 1 марта 2022 годаСкачать

1 №5.1. ФАРМАКОКИНЕТИКА, БИОТРАНСФОРМАЦИЯ ЛВСкачать